EFR BPCO
Diagnostic clinique, mini spirométrie, et spirométrie au cabinet ?
T. Perez - Clinique des Maladies Respiratoires et Service EFR, CHRU de Lille
R. Sion, MG Lille
Formathon 2015
Position du problème
La BPCO atteint environ 7 à 8 % des adultes de plus de 40 ans, et le nombre de patients est estimé à environ 3,5 millions en France. Si le tabac reste de loin la principale cause de BPCO, les facteurs professionnels peuvent être incriminés seuls ou en association au tabac dans 10 à 20 % des cas.
Les études basées sur des spirométries systématiques chez les sujets à risque en population générale ont montré que 70 % des patients atteints de BPCO restaient actuellement méconnus.
Eléments cliniques
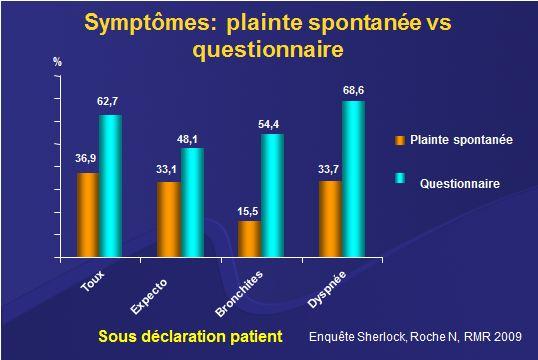
Chez un patient ayant un facteur de risque significatif (tabagisme > 10 paquets années, exposition professionnelle ou domestique) les sympxômes évocateurs de BPCO doivent être recherchés systématiquement vu leur banalisation par les patients qui ne s’en plaignent pas. C’est particulièrement le cas pour la la bronchite chronique et la dyspnée attribués au tabac, au vieillissement ou au manque d’exercice. Dans une étude en médecine générale, tous les sympxômes caractéristiques de BPCO étaient beaucoup fréquents sur questionnaire par rapport à la plainte spontanée 1
En pratique, comment faire le diagnostic de BPCO ?
Diagnostic clinique
Les sympxômes évocateurs de BPCO sont ceux proposés par les recommandations GOLD2 et doivent au minimum être recherchés systématiquement :
• 1) avez-vous plus de 40 ans,
Et
• 2) fumez vous ou avez-vous fumé
• ou été exposé à des gaz poussières fumées
Et au moins une réponse +
• 3) toussez vous souvent ?
• 4) crachez vous souvent ?
• 5) pour une tâche donnée êtes vous plus essoufflé que les personnes de votre âge ?
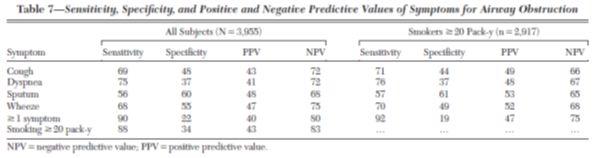
La spécificité et la sensibilité de ce questionnaire n’ont cependant pas été évaluées. Une étude récente a cependant montré la faible spécificité de chaque sympxôme individuel et il est donc exclu de poser le diagnostic de BPCO sur la seule présence d’une bronchite chronique et/ou d’une dyspnée chez un fumeur. Ainsi dans l’étude d’Ohar3 sur une population de sujets fumeurs la sensibilité des signes toux dyspnée expectoration sifflements allait de 57 % à mais avec une spécificité moyenne, y compris chez les fumeurs (≥ 20 paquets-années)
Des questionnaires plus structurés à score ont été proposés, comme le COPD-PS ou le LFQ. Ces questionnaires validés ont une sensibilité de l’ordre de 70 à 80 % (mais au prix d’une spécificité de l’ordre de 25 %). Ils pourraient être prochainement disponibles en France.

Lien de téléchargement de ce questionnaire
La survenue d’une « bronchite » correspondant en fait à une exacerbation peut également être l’occasion d’évoquer le diagnostic.
L’examen clinique peut apporter des arguments supplémentaires (distension, râles bronchiques, diminution du murmure vésiculaire, signes de décompensation cardiaque, cyanose……) mais sa sensibilité est faible aux stades peu évolués.
Dans l’enquête Inhalez effectuée en 2012-2013, 37 % des 2681 patients étiquetés BPCO l’étaient sur les éléments cliniques seuls, sans confirmation spirométrique4. Il est probable que la proportion de diagnostics cliniques soit encore plus élevée dans la vraie vie.
Mesure du souffle
Débit de pointe et VEMS électronique
Le mesure du souffle permet de compléter l’évaluation clinique systématique ci-dessus et apporte des arguments en faveur d’un trouble ventilatoire obstructif (TVO), dont la démonstration est indispensable pour confirmer le diagnostic de BPCO (versus une bronchite chronique simple par exemple).
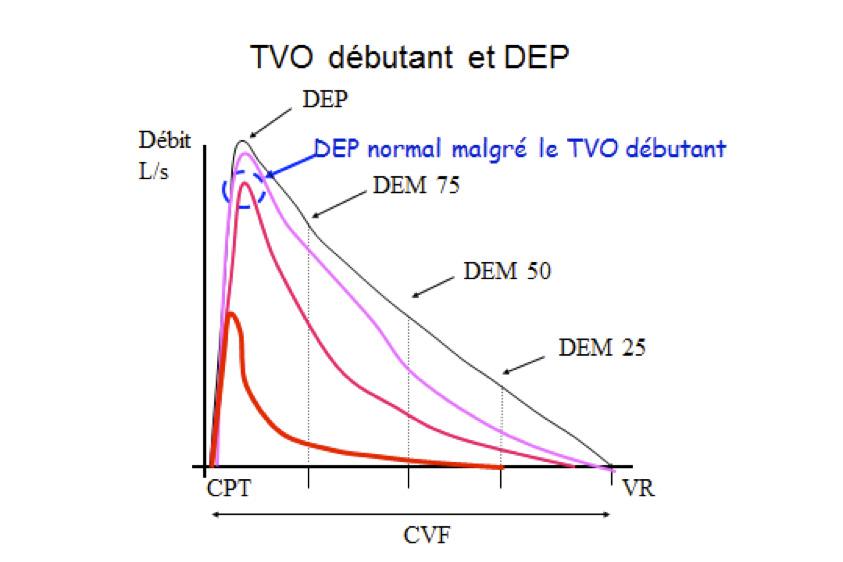
Le débit de pointe avec un débitmètre mécanique a classiquement une faible sensibilité pour détecter un TVO débutant ou modéré comme le montre la courbe débit-volume ci-dessous :
Cependant deux études récentes à large échelle ont montré une sensibilité correcte du débit de pointe électronique (spiromètre ou mini-spiromètre) pour la détection d’une BPCO avérée modérée à sévère 5 6.
Minispiromètres
Afin d’améliorer cette détection, la SPLF a proposé dans son plan d’action BPCO 2005-2010 l’utilisation de mini-spiromètres pour mettre en évidence l’existence d’un TVO chez tous les patients à risque de BPCO.
Les mini-spiromètres proposés étaient principalement le PIko 6® et le BPCO 6®, ce dernier ayant l’avantage d’une manipulation plus aisée et d’exprimer les résultats en pourcentage de la théorique après entrée de la taille, de l’âge et du sexe.

L’utilisation de ces mini spiromètres a fait l’objet de formations courtes dans le cadre du plan BPCO.
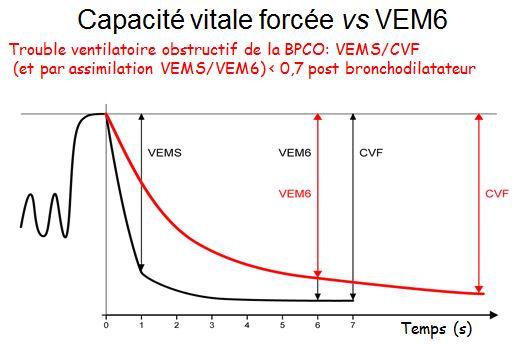
Le principal objectif était de mettre en évidence un TVO à partir du rapport VEMS/VEM6. Le VEM 6 est un substitut de la capacité vitale forcée, souvent sous-estimée du fait d’une expiration incomplète lors des manœuvres.
Si leurs mesures sont fiables, les critères de qualité des manœuvres sont identiques à ceux de la spirométrie vraie, avec l’inconvénient supplémentaire de ne pas visualiser les courbes. On dispose cependant de messages d’erreur et l’obtention des 6 secondes d’expiration nécessaires pour le VEM6 est repérée par un bip sonore.
Plusieurs études versus spirométrie ont pourtant validé la pertinence de ces mini spiromètres pour détecter l’existence d’une BPCO, en utilisant des seuils de 0,7 à 0,75 pour le rapport VEMS/VEM6.

Malheureusement après un certain enthousiasme initial leur utilisation s’avère actuellement très réduite en médecine générale, les principaux obstacles étant le manque de temps et les difficultés d’utilisation.
Spirométrie
Plusieurs modèles de spiromètres simples ont été développés ces dernières années pour une utilisation au cabinet du MG, avec ou sans test de réversibilité. Les plus adapxés sont ceux utilisant des capxeurs à usage unique de type turbine, pneumotachographe ou filtrette (capxeur ultrasonique).
Modèle Minispir de Mediflux (que nous remercions pour son soutien logistique à cet atelier avec le prêt gracieux de matériel)

La réalisation correcte d’une spirométrie nécessite une formation suffisante et un contrôle qualité des courbes obtenues, initialement et à intervalle régulier. L’entretien et le calibrage du matériel doivent également être effectués selon les recommandations du fabricant. Un contrôle biologique hebdomadaire est également souhaitable.
La durée des programmes de formation des MG est variable selon les pays, allant jusqu’à 12 heures en Belgique. En France, une formation dans le cadre du DPC devrait être mise en place fin 2014, avec un format de l’ordre de 6 heures incluant une formation théorique et pratique avec manipulation, ainsi que des cas cliniques. Il est en tout cas impossible de réaliser des examens de qualité après une simple formation d’une heure par le fournisseur !
Point important, la cotation de l’acte «spirométrie standard » GLQP012 comprend la réalisation d’une spirométrie lente et forcée.
Un minimum de 3 mesures accepxables et reproductibles est nécessaire pour la validité de l’examen, avec des critères très stricts proposés par l’ATS/ERS en 2005 7.
1) Critères d’accepxabilité de la CVF
• Absence de toux ou de fermeture de glotte
• Effort suffisant et reproductible
• Expiration complète:
– Durée expiration > 6 secondes
– Ou plateau sur la courbe temps-volume
– Ou « temps raisonnable »
– Ou Sujet incapable de poursuivre l’expiration
• Bon départ
– Débit de pointe précoce, délai < 120 ms
– Ou extrapolation arrière du VEMS < 5 % de la CVF ou < 100 ml
2) Critères de reproductibilité de la CVF
Après 3 manœuvres techniquement satisfaisantes
Pour le VEMS et la CVF:
a. Écart < 150 ml pour les deux paramètres
Sinon poursuivre jusqu’à:
b. Obtention de ces critères
c. Maximum de 8 tests
d. Ou sujet incapable de poursuivre
Sauvegarder les trois meilleurs tests
Des recommandations spécifiques sur la spirométrie par le MG ont été publiées par le General Practice Airways Group 8
Place de la spirométrie pour le diagnostic de BPCO
L’obstruction bronchique fait partie de la définition de la BPCO et doit être mise en évidence pour affirmer le diagnostic chez un patient présentant des facteurs de risque de BPCO ou des sympxômes évocateurs. Le diagnostic de BPCO repose sur la mise en évidence par la spirométrie d’un trouble ventilatoire obstructif (TVO) permanent, non complètement réversible. La définition opérationnelle du TVO pour le diagnostic de BPCO est un rapport VEMS/CVF < 0,70 post bronchodilatateur 2,9,10. Sa sévérité spirométrique est évaluée par le VEMS post bronchodilatateur en pourcentage de la théorique. (figure 1).
Un test de réversibilité doit être pratiqué lors du bilan diagnostique initial. Une réversibilité spirométrique significative est définie par une augmentation du VEMS et/ou de la CVF supérieure ou égale à 12 % et au moins 200 ml après l’inhalation d’un β2-mimétique et/ou un anticholinergique de courte durée d’action
L’existence d’une réversibilité significative du VEMS et/ou de la CVF ne suffit pas pour différencier un asthme d’une BPCO. Une réversibilité très importante est parfois obtenue chez des patients considérés cliniquement comme d’authentiques BPCO 11,12. L’intérêt du test de réversibilité pour le diagnostic de BPCO est essentiellement de montrer que le TVO n’est pas complètement réversible, auquel cas le patient ne remplit plus les critères de BPCO.
Sévérité
La sévérité spirométrique est basée sur le VEMS en pourcentage de la théorique, et pour le stade IV sur les données gazométriques si le VEMs est > 30 % théo.

Cependant, les recommandations GOLD plus récentes 13,14 préconisent de tenir compxe d’autres éléments pour évaluer la sévérité de la maladie. Il s’agit du taux d’exacerbations (considérées comme fréquentes si ≥2/an) de la dyspnée (échelle mMRC) et de la qualité de vie. Cette dernière peut être évaluée de façon simple par le COPD assessment questionnaire (CAT) à 8 questions ou le Clinical COPD questionnaire (CCQ) à 10 questions.
Conséquences pratiques de la détection
La détection idéalement précoce d’un patient BPCO a de multiples avantages. Le premier est l’éviction précoce des facteurs de risque avec en premier lieu le sevrage tabagique mais aussi les mesures en milieu professionnel. Plusieurs études suggèrent l’obtention d’un taux de sevrage tabagique plus élevé chez les patients dépistés, après annonce diagnostique15,16. Le deuxième intérêt est de traiter précocement les sympxômes et notamment la dyspnée, source de limitation et de handicap. Le maintien précoce d’une activité physique régulière est également un objectif important, celle-ci diminuant dès le stade 2. Il serait également légitime de proposer plus précocement une réhabilitation aux patients présentant d’emblée un handicap significatif, après opximisation du traitement médicamenteux. La découverte d’une BPCO peut également amener à la mise en évidence de comorbidités : cardio vasculaire, ostéoporose, dépression notamment. Enfin l’évaluation précise de la sévérité de la BPCO permet un meilleur ajustement des traitements de fond et de la prise en charge des exacerbations, en conformité avec les recommandations. Inversement il est probable que des patients soient actuellement étiquetés à tort de BPCO et traités comme tels sur les seuls éléments cliniques, dont la spécificité est insuffisante.
Points clés
- La détection de la BPCO est sensibilisée par les questionnaires systématiques à la recherche des sympxômes cardinaux de la maladie, ceux-ci étant banalisés par les patients.
- Le diagnostic clinique seul est insuffisant car trop peu spécifique.
- Bien qu’insuffisante seule, la mesure du DEP ou du VEMS électronique peut apporter un argument supplémentaire en faveur d’un trouble ventilatoire obstructif (TVO) mais ne détecte pas les stades légers.
- La spirométrie avec test de réversibilité est indispensable pour confirmer le diagnostic et évaluer la sévérité du TVO.
- La spirométrie est parfaitement réalisable par le médecin généraliste mais nécessite une formation adéquate et une méthodologie rigoureuse
Un complément d'information sur les volumes pulmonaires est disponible via ce lien et également par les rubriques :
-FORMATHONS > Compléments aux Formathons
-LIENS-SERVICES
Références
1 Roche N, Perez T, Martinat Y, et al. [Difficulties in the assessment of dyspnea and respiratory function in general practice]. Presse Med 2009; 38:1041-1048
2 GOLD. Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2010, 2010
3 Ohar JA, Sadeghnejad A, Meyers DA, et al. Do sympxoms predict COPD in smokers? Chest 2010; 137:1345-1353
4 Perez T SR, Glantenet R, Bourdeix I, Lecocq B. Profil et prise en charge des patients BPCO en médecine générale en 2012-2013 : enquête INHALEZ. Congrès de Pneumologie de Langue Française. Marseille, 2014
5 Jithoo A, Enright PL, Burney P, et al. Case-finding opxions for COPD: results from the Burden of Obstructive Lung Disease study. Eur Respir J; 41:548-555
6 Nelson SB, LaVange LM, Nie Y, et al. Questionnaires and pocket spirometers provide an alternative approach for COPD screening in the general population. Chest 2012; 142:358-366
7 Miller MR, Hankinson J, Brusasco V, et al. Standardisation of spirometry. Eur Respir J 2005; 26:319-338
8 Levy ML, Quanjer PH, Booker R, et al. Diagnostic spirometry in primary care: Proposed standards for general practice compliant with American Thoracic Society and European Respiratory Society recommendations: a General Practice Airways Group (GPIAG)1 document, in association with the Association for Respiratory Technology & Physiology (ARTP)2 and Education for Health3 1 www.gpiag.org 2 www.artp.org 3 www.educationforhealth.org.uk. Prim Care Respir J 2009; 18:130-147
9 NICE. Chronic obstructive pulmonary disease: Management of chronic obstructive pulmonary disease in adults in primary and secondary care. London: National Clinical Guideline Center, 2010
10 SPLF. Recommandations de la Société de Pneumologie de Langue Française sur la prise en charge de la BPCO (mise à jour 2009). Revue des Maladies Respiratoires 2010; 27:S1-S76
11 Calverley PM, Burge PS, Spencer S, et al. Bronchodilator reversibility testing in chronic obstructive pulmonary disease. Thorax 2003; 58:659-664
12 Tashkin DP, Celli B, Decramer M, et al. Bronchodilator responsiveness in patients with COPD. Eur Respir J 2008; 31:742-750
13 GOLD. Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2011
2011
14 Vestbo J, Hurd SS, Agusti AG, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med 2013; 187:347-365
15 Gorecka D, Bednarek M, Nowinski A, et al. Diagnosis of airflow limitation combined with smoking cessation advice increases stop-smoking rate. Chest 2003; 123:1916-1923
16 Parkes G, Greenhalgh T, Griffin M, et al. Effect on smoking quit rate of telling patients their lung age: the Step2quit randomised controlled trial. BMJ 2008; 336:598-600